
ASPIVIX erhält die CE-Zulassung für Carevix™
ASPIVIX erhält die CE-Zulassung für Carevix™ zur Schmerzreduzierung bei IUPs und transzervikalen Eingriffen, erweitert die Zusammenarbeit mit Botschaftern weltweit und verbessert die Gesundheit von Frauen ohne Angst vor Schmerzen.
Epalinges, Schweiz – 18. Dezember 2023 – ASPIVIX, ein innovativer Hersteller von Medizinprodukten zur Verbesserung der gynäkologischen und Fruchtbarkeitsversorgung, gab bekannt, dass carevix™, sein neuartiger Zervikalstabilisator, die CE-Kennzeichnung erhalten hat. Dieses Gerät der nächsten Generation für Routineverfahren in der Gynäkologie wird Millionen von Frauen in ganz Europa den Zugang zu deutlich weniger schmerzhaften Behandlungen und Einführungen von Spiralen ermöglichen.

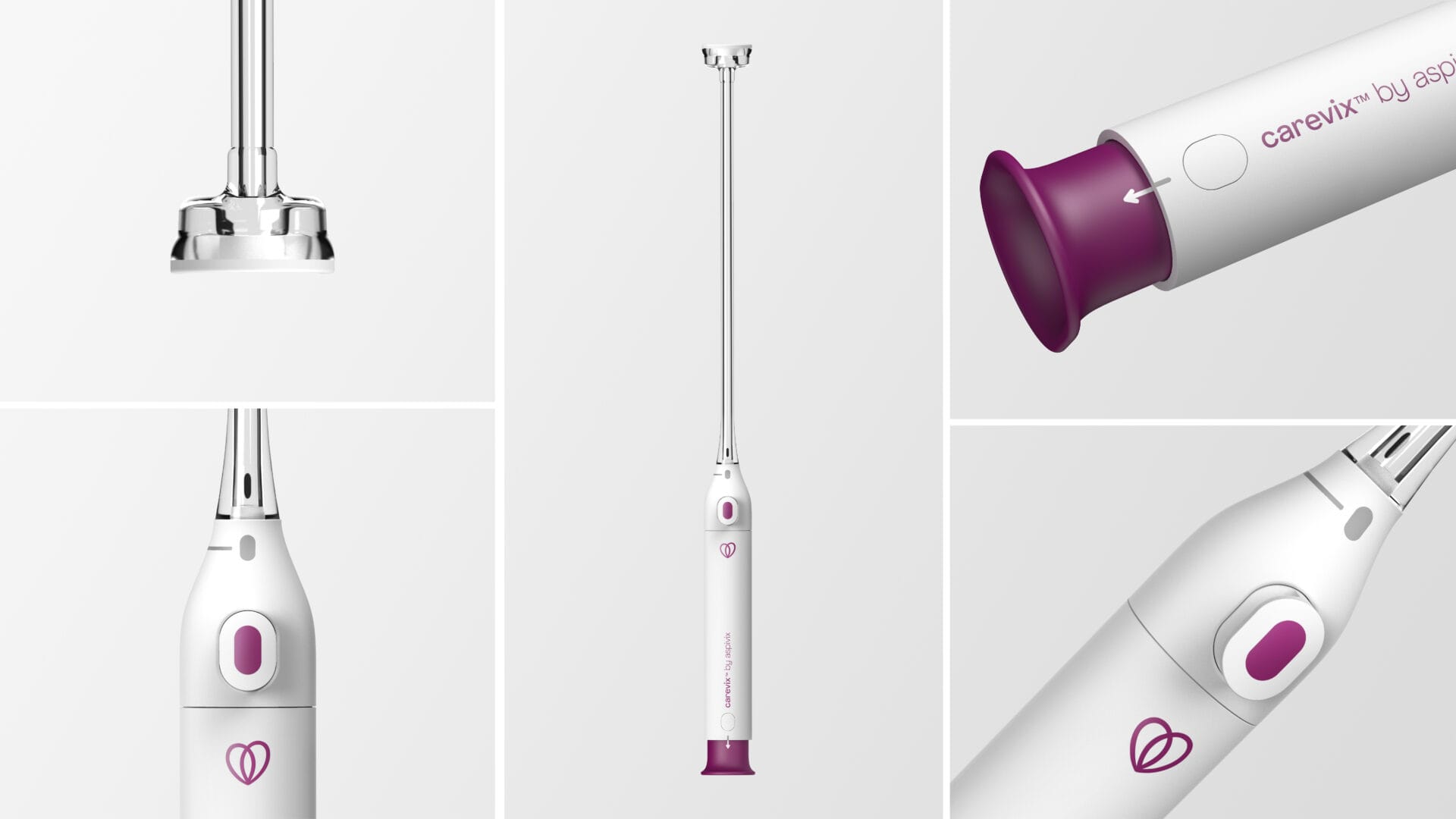
Carevix™ ist ein zervikaler Stabilisator, der einen sanften Ansatz zur Minimierung von Schmerzen und Blutungen während verschiedener transzervikaler Eingriffe, einschließlich der Platzierung eines Intrauterinpessars, verwendet. Carevix™ ist das Ergebnis des konstanten Engagements von ASPIVIX, die Gynäkologie modern zu gestalten.
Die in der internationalen Fachzeitschrift Contraceptionveröffentlichten Ergebnisse der ADVANCE Women, einer einfach verblindeten, randomisierten, multizentrischen Vergleichsstudie mit 100 Frauen, die sich einer IUP-Einlage mit dem Carevix™-Gerät oder einem herkömmlichen Zervix-Tenaculum unterzogen, zeigten, dass Frauen, die sich einer IUP-Einlage mit dem Carevix™-Gerät unterzogen, statistisch und klinisch signifikante Ergebnisse mit einer bis zu 73%igen Verringerung der Schmerzwerte und einer 78%igen Verringerung der Blutungsraten erzielten.(1)
Der CEO von ASPIVIX, Mathieu Horras, betonte, dass „Das carevix™-Gerät, das Anfang des Jahres auch die 510(k)-Zulassung erhalten und einen Designpreis gewonnen hatte, bietet eine innovative, klinisch erprobte und benutzerfreundliche Alternative zu einem jahrhundertealten gynäkologischen Hilfsmittel. Die umfangreiche Forschung, die in die Entwicklung von carevix™ eingeflossen ist, sorgt für eine deutliche Verringerung von Schmerzen und Blutungen und verbessert die Erfahrung bei der Einführung und Platzierung von Spiralen sowie bei vielen anderen gynäkologischen und Fruchtbarkeitsverfahren für Millionen von amerikanischen und europäischen Frauen. .“
Neben der 510(k)-Freigabe ist diese CE-Zulassung ein sehr wichtiger Meilenstein, der es ASPIVIX ermöglicht, weltweit zu expandieren und mit Botschaftern (Gynäkologen, Hebammen, Krankenschwestern) in 12 Exzellenzzentren (USA, Frankreich, Schweden, Schweiz, Deutschland und Österreich) zusammenzuarbeiten, die carevix™ in der Routine verwenden, unschätzbare Erkenntnisse gewinnen und – was am wichtigsten ist – Frauen eine bessere Erfahrung in der Gynäkologie bieten. Es zeigt unser Engagement für Innovation, die Förderung der Zusammenarbeit und die Verbesserung der Patientenergebnisse durch die Weiterentwicklung unserer Produkte in der klinischen Praxis.
- Die CE-Zulassung folgt auf die Zulassung durch die US-FDA ab Januar 2023.
- Schmerzen sind der häufigste Grund für den Verzicht auf die kosteneffektive und zu 99% wirksame Verhütungsmethode (IUP), von der jedes Jahr etwa 100 Millionen Frauen weltweit betroffen sind.
- Unausgesprochene und unterschätzte Schmerzen führen zu Verzögerungen bei Diagnostik und Behandlung, was weltweit zu 121 Millionen ungewollten Schwangerschaften führt, von denen 60% mit einer Abtreibung enden (Quelle: WHO).
Über Aspivix
Aspivix ist ein führendes Unternehmen im Bereich der Frauengesundheit, das sich der Modernisierung von Gesundheitslösungen für Frauen auf der ganzen Welt verschrieben hat. Aspivix hat sich der Entwicklung innovativer medizinischer Geräte verschrieben, wie z.B. Carevix™, die die gynäkologische Erfahrung durch sicherere und weniger schmerzhafte Lösungen verändern sollen, die die Qualität der Versorgung verbessern und Frauen befähigen, die Kontrolle über ihre Gesundheit zu übernehmen.
Über Carevix™
Carevix™ ist ein innovatives Zervixgerät mit weicher Absaugung, das als moderne und sanfte Alternative zu einem Zervix-Tenaculum entwickelt wurde, wenn eine Stabilisierung des Gebärmutterhalses erforderlich ist, mit dem Ziel, das mit Schmerzen und Blutungen verbundene Trauma deutlich zu reduzieren.
Carevix™ hat klinisch bewiesen, dass es bei transzervikalen Eingriffen atraumatisch ist. Die äußerst überzeugenden Ergebnisse der ADVANCE Women (Atraumatic Device using Vacuum Technology for Cervical Procedures in WOMEN), einer randomisierten, kontrollierten Studie zu Carevix™, die bei IUP-Eingriffen gegen das Zervix-Tenaculum eingesetzt wird, wurden im März 2023 in „Contraception“, dem International Reproductive Health Journal, veröffentlicht.
Carevix™ hat die FDA-Zulassung und nun auch die CE-Zulassung im Jahr 2023 erhalten, so dass Carevix™ sehr bald in Europa und den Vereinigten Staaten von Amerika auf den Markt kommen kann.
Für Medienanfragen oder weitere Informationen :
Bitte kontaktieren Sie: Ikram Guerd – VP of Global Marketing: ikram.guerd@aspivix.com.
Referenzen
(1). Michal Yaron, Hélène Legardeur, Bastien Barcellini, Farida Akhoundova, Patrice Mathevet, Safety and efficacy of a suction cervical stabilizer for IUD insertion: results from a randomized, controlled study, Contraception, 2023, 110004, ISSN 0010-7824, Contraception link
Share this story:










